L'atomo è la più piccola parte di un elemento chimico che conserva le proprietà chimiche dell'elemento stesso.
L'atomo è formato da elettroni che si muovono attorno a un nucleo composto (in uno schema molto semplificato) da protoni e neutroni. Nel nucleo è quasi del tutto concentrata la massa dell'atomo. Gli atomi sono particelle piccolissime, il loro diametro si misura in Angstrom Å (1Å=10-10m).
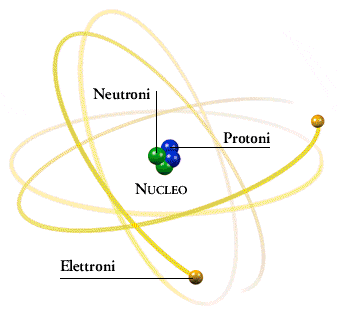
Il numero di protoni di un atomo corrisponde al numero atomico, mentre la somma tra numero di protoni e numero di neutroni corrisponde al numero di massa. Gli elettroni esterni al nucleo, sono numericamente uguali al numero di protoni.
Le sostanze semplici, o elementi, sono costituiti da atomi della stessa specie; le sostanza composte, o composti, da atomi di specie diverse, ma sempre in rapporti numerici ben definiti e generalmete semplici.
Più atomi legati tra loro formano le molecole.
L'atomo nella storia
Il concetto di atomo come particella indivisibile (da cui il nome, derivato da greco) venne elaborato nell'antichità in ambito filosofico (Leucippo e Democrito, V-IV a.C.); assunse in seguito il carattere di ipotesi e poi di teoria scientifica con la scoperta delle leggi ponderali (fine XVIII secolo e inizi XIX secolo) .
Nella seconda metà del XIX secolo, principalmente con J.C. Maxwell e L. Boltzmann, si sviluppa la teoria cinetica dei gas che, per la prima volta, interpreta fenomeni fisici macroscopici (pressione, temperatura, ecc.) mediante semplicissime ipotesi sulla struttura atomica della materia. La cristallografia induce a supporre che anche le proprietà dei solidi possano tovare una spiegazione nella loro struttura atomica, in questo caso perfettamente regolare.
Alla fine del secolo XIX le scoperte dell'elettrone e della radioattività aprono la via allo studio della struttura dell'atomo e del suo legame con la spettroscopia.
Agli inizi del XX secolo sono ormai tantissimi i fenomeni in cui l'atomo interviene come elemento essenziale. Per giustificarne altri, invece, nasce la teoria dei quanti e viene applicata alla struttura dell'atomo. Nascono in questi anni anche i primi modelli atomici. Il primo (1904) fu il modello atomico proposto da J.J. Thomson. Il secondo (1911) è ilmodello atomico proposto da E. Rutherford.
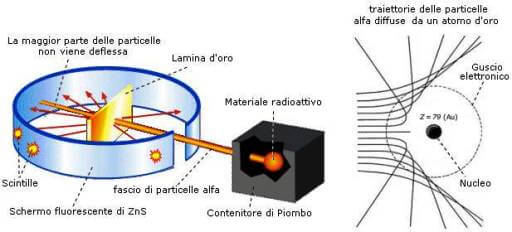
L'esperimento di Rutherford che sancisce la nascita del suo modello atomico
N. Bohr nel 1913 formulò il suo modello atomico noto come modello atomico di Bohr. Via via questi modelli si sono ulteriormente raffinati per tener conto di nuove scoperte, portando all'attuale concezione della struttura atomica rappresentata dal modello atomico a orbitali.
L.S.C.P.
La Scienza Che Passione vi augura buona permanenza. LSCP
Questo sito è stato realizzato con Jimdo! Registra il tuo sito gratis su https://it.jimdo.com
